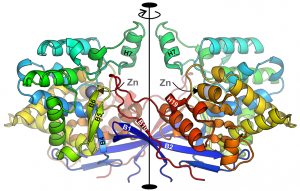
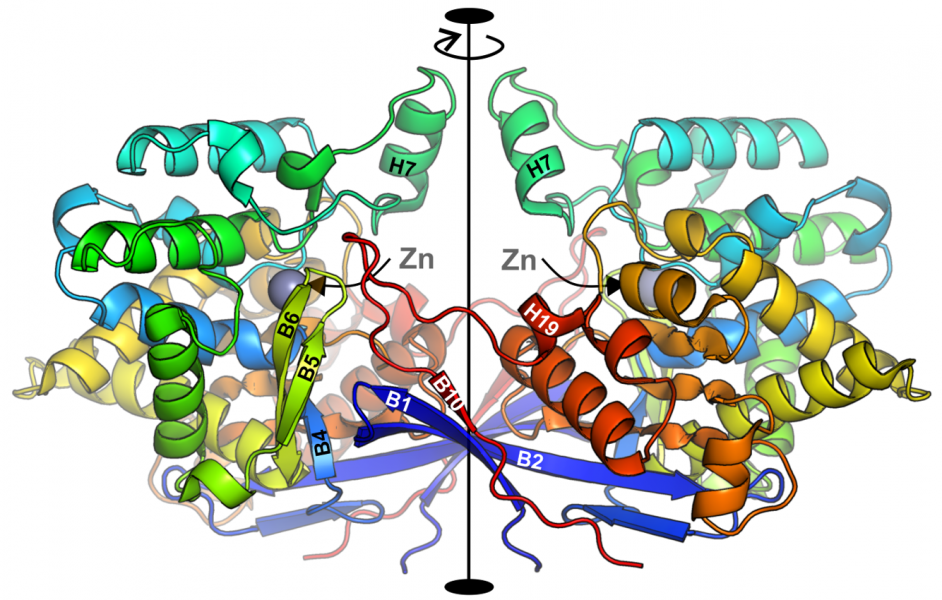
Na łamach prestiżowego czasopisma Nature Communications ukazała się praca pt. „Crystal structures of the elusive Rhizobium etli L-asparaginase reveal a peculiar active site” opublikowana przez zespół (Joanna Loch, Barbara Imiołczyk, Joanna Śliwiak, Anna Wantuch, Magdalena Bejger, Mirosław Gilski, Mariusz Jaskólski) pod kierunkiem prof. Mariusza Jaskólskiego z Zakładu Krystalografii Wydziału Chemii UAM. Wśród autorów jest również prof. UAM Mirosław Gilski z tego samego Zakładu. W pracy opisano funkcję enzymatyczną oraz strukturę przestrzenną nowego enzymu (nazwanego ReAV) rozkładającego prosty aminokwas - asparaginę - do kwasu asparaginowego i amoniaku. Enzymy o takiej funkcji, zwane asparaginazami, są pilnie poszukiwane przez medycynę, gdyż przy spełnieniu pewnych dodatkowych warunków mogą okazać się doskonałymi lekami w terapii ostrej białaczki u dzieci. Opisany w publikacji enzym nie spełnia wszystkich kryteriów doskonałego leku, lecz poznanie jego struktury daje szansę na takie jej „ulepszenie”, by te kryteria spełnić. Enzym ReAV jest nowy w tym sensie, że jego struktura całkowicie zaskoczyła badaczy znających asparaginazy od podszewki. Z drugiej strony, batalia o poznanie struktury białka ReAV toczyła się prawie 20 lat. Świadczy to zarówno o skali problemu, jak i o skali osiągnięcia. Opisane w pracy badania były finansowane przez grant NCN OPUS 2020/37/B/NZ1/03250.
Praca zespołu pod kierunkiem prof. Mariusza Jaskólskiego opublikowana na łamach Nature Communications