Nagroda Nobla 2022 za pracę nad innowacyjną metodą syntezy organicznej (click chemistry) dla Carolyn R. Bertozzi (Uniwersytet Stanforda; USA), Mortena Meldala (Uniwersytet w Kopenhadze; Dania) i K. Barry’ego Sharplessa (Scripps Research Institute w La Jolla; Kalifornia, USA).
Motto: “all searches must be restricted to molecules that are easy to make”
K. B. Sharpless
W roku 2001 profesor K. Barry Sharpless z Instytutu Scripps, laureat nagrody Nobla z roku 2001, ogłosił w Angewandte Chemie manifest chemii klik [1], w którym stwierdza, że jeden z głównych celów syntezy organicznej jakim jest synteza związków o pożądanych właściwościach („wytwarzanie właściwości”) może być zrealizowany w prostszy niż dotychczas sposób. Warto tutaj zaznaczyć, że mimo spektakularnego rozwoju syntezy organicznej nie ma jednej efektywnej drogi „wytwarzania właściwości” a w ostatnich latach jedynie chemię kombinatoryczną połączoną z technikami wysokowydajnych badań przesiewowych (ang. high throughput screening) oraz syntezę kierowaną celem (Target Guided Synthesis, TGS) uznać można za znaczące. Punktami wyjścia dla nowatorskiej koncepcji Sharplessa, nazwanej click chemistry są następujące obserwacje:
- Chemicy organicy „przeinwestowują” strukturę, ponieważ poszukiwane przez nich właściwości mogą być także obecne w związkach łatwych do syntezy. Zatem próby syntez złożonych produktów naturalnych, ich analogów, rozwijanie reakcji trudnych do kontrolowania lub izolacji produktów są krętą i wyboistą drogą syntezy, tak w wymiarze efektywności, czasochłonności jak i kosztów. Przykładami mogą być syntezy przeciwrakowego taksolu i taksanów (kilka lat pracy) czy popularna reakcja aldolowa, która jest słabo „napędzana” termodynamicznie. Należy zatem przesunąć punkt ciężkości działań z syntezy ukierunkowanej na wybrany cel (target-oriented synthesis), którym często jest złożony produkt naturalny na łatwą syntezę wielu związków „lekopodobnych” (drug-like oriented synthesis), które mogą być „nośnikami” pożądanych właściwości.
- Natura preferuje syntezę wiązań węgiel-heteroatom i większość biomolekuł np. biopolimerów złożona jest z małych bloków zawierających i połączonych ze sobą za pomocą takich właśnie wiązań. Zatem należy rozwijać metody efektywnego tworzenia wiązań węgiel-heteroatom.
- Według szacunków pula potencjalnych kandydatów na leki, obejmująca cząsteczki o masie poniżej 500 daltonów, poniżej 30 atomów (bez wodoru), zawierających tylko atomy C, H, O, N, S, P, F, Cl lub Br, trwałych w temperaturze pokojowej oraz odpornych na wodę i tlen, wynosi 1062-1063, z czego otrzymanych zostało około 106-107. To powinna być przestrzeń do eksploracji przez syntetyków!
Czymże zatem jest koncepcja click chemistry? Jest to synteza złożonych związków organicznych, które można łatwo otrzymać stosując pulę reakcji, które charakteryzuje:
- wysoka wydajność związana z wysoką aktywacją termodynamiczną reakcji
- niechromatograficzne metody oczyszczania produktów i brak trudnych do oddzielenia składników mieszanin reakcyjnych
- wysoka ogólność (ważna przy otrzymywaniu dużych bibliotek związków z różnych substratów posiadających odpowiednie grupy reaktywne )
- proste warunki prowadzenia (preferowana woda lub dostępne rozpuszczalniki jako media reakcyjne, produkty trwałe w warunkach fizjologicznych – woda, tlen)
- stereospecyficzność (ale niekoniecznie enancjoselektywność).
Tak wyselekcjonowany zbiór reakcji stanowi po prostu zestaw wydajnych narzędzi do syntezy. Warto zwrócić uwagę, że w przypadku syntezy zadanych z góry struktur nacisk położony jest na cel i często reakcje problematyczne także muszą zostać włączone do syntezy a podane wyżej kryteria są brane pod uwagę jedynie w miarę możliwości. Synteza za pomocą chemii klik z definicji eliminuje reakcje problematyczne.
Jakie reakcje spełniają zatem kryteria zadane przez Sharplessa? Ich cechą wspólną jest silna aktywacja termodynamiczna, zwykle wynosząca powyżej 20 kcal/mol, która jest odpowiedzialna za wysoką wydajność i szybkość oraz selektywność (a substraty traktować można jako „naładowane energią”, ang. spring-loaded). Przykładami takich transformacji są przedstawione na Schemacie poniżej reakcje nukleofilowego otwarcia naprężonych trójczłonowych pierścieni (epoksydy, azyrydyny itp.), cykloaddycje (np. 1,3-dipolarna oraz np. Dielsa-Aldera), addycje do wiązań wielokrotnych (epoksydowanie, dihydroksylowanie, reakcja Michaela) oraz wybrane typy addycji do grupy karbonylowej (np. synteza moczników, oksymów, imin, amidów, niektórych heterocykli).
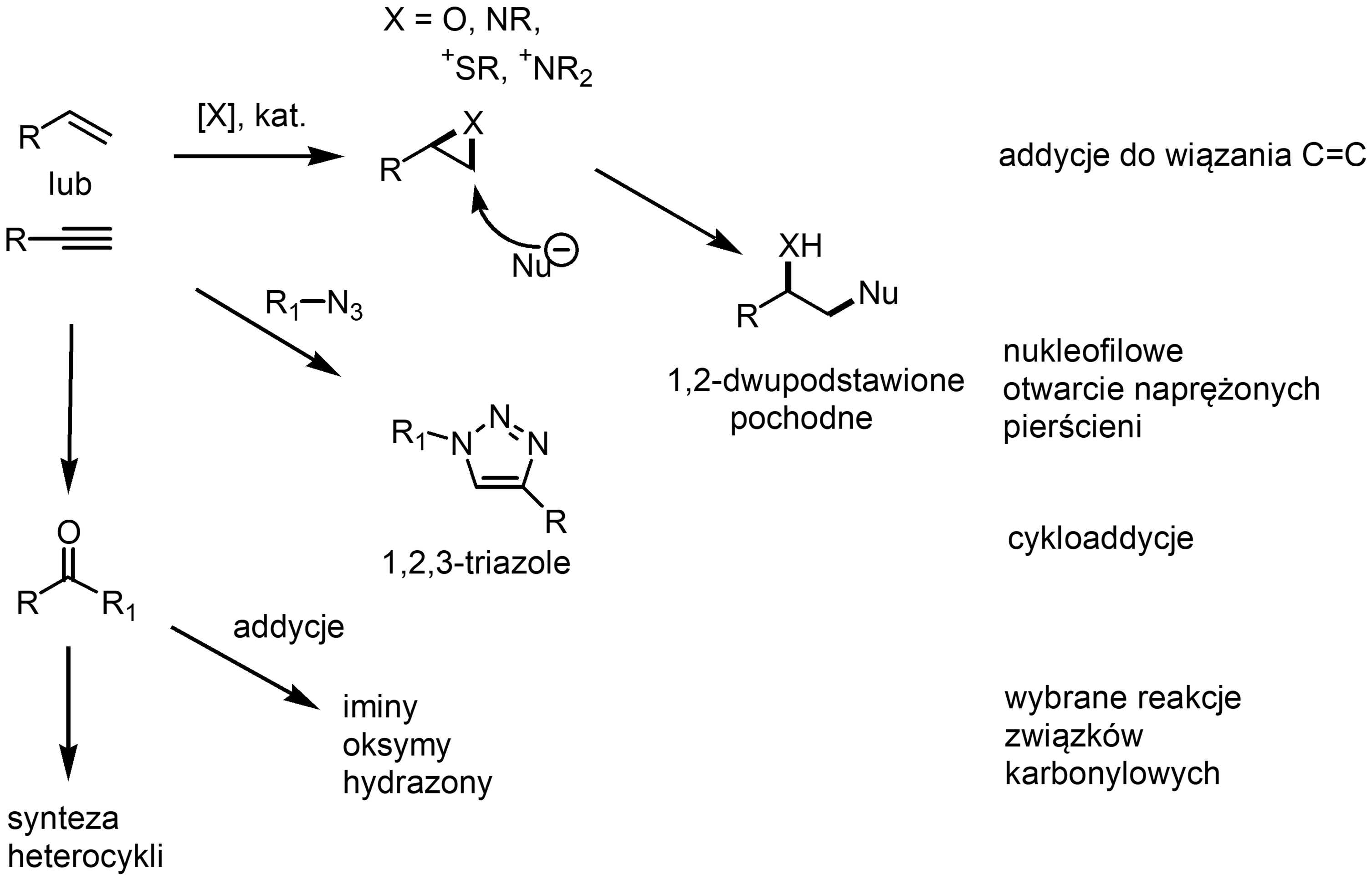
1,3-Dipolarna cykloaddycja Huisgena – modelowa reakcja click chemistry
Jakkolwiek wiele jest reakcji spełniających kryteria koncepcji click chemistry, bez wątpienia katalizowana Cu(I) 1,3-dipolarna cykloaddycja Huisgena (odkryta niezależnie przez Sharplessa i Meldala) stała się głównym narzędziem, przy pomocy którego zademonstrowano jej użyteczność. Zadecydowały o tym zarówno zalety samej reakcji jak i właściwości produktów – 1,2,3-triazoli. Reakcja ta zachodząca między azydkami a alkinami z wysoką aktywacją termodynamiczną (35-50 kcal/mol), została opisana już w roku 1963 przez R. Huisgena i jest stosowana w chemii heterocykli jako podstawowa droga syntezy 1,2,3-triazoli, które same wykazują szereg interesujących właściwości biologicznych.
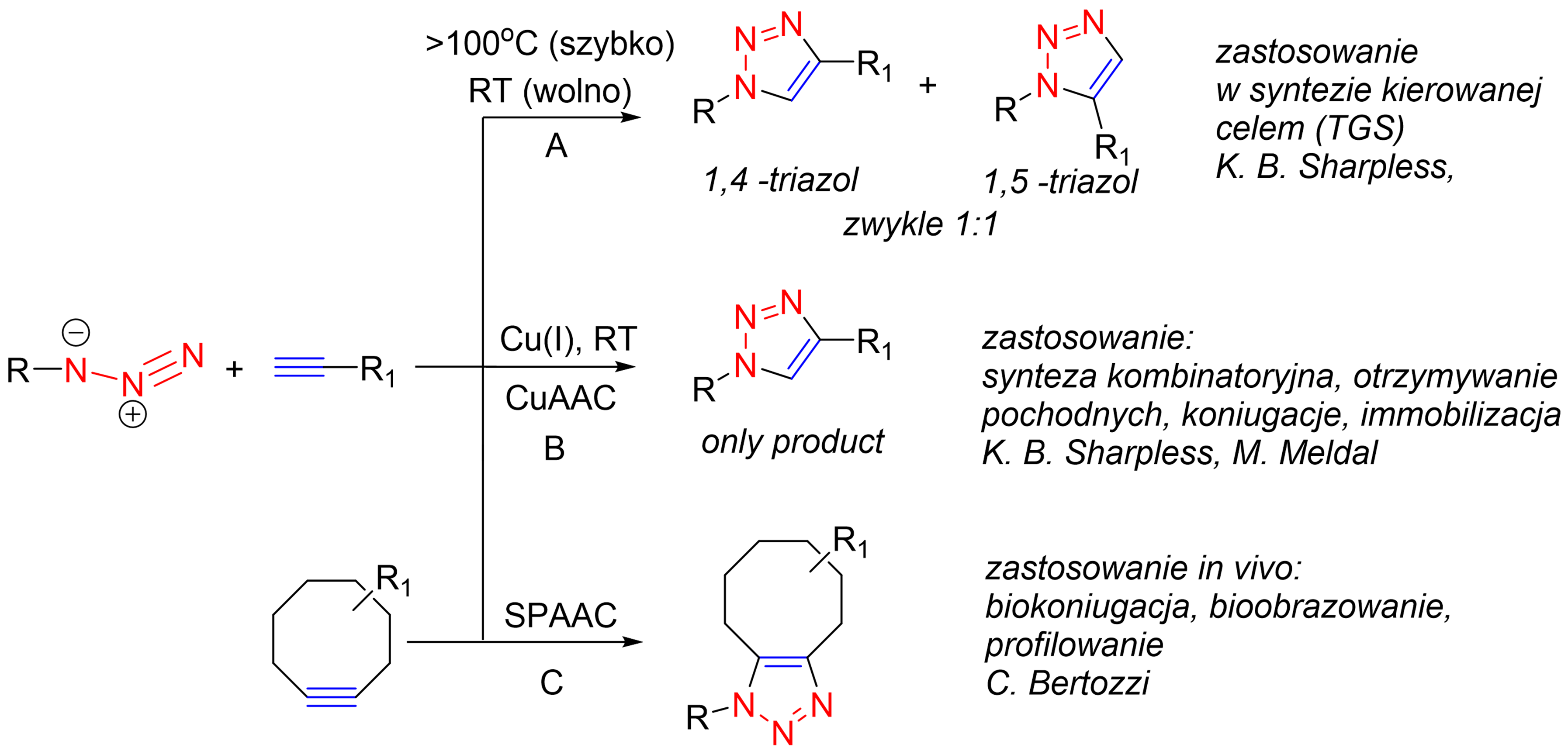
Schemat 1. Ogólne metody syntezy 1,2,3-triazoli z azydków i alkinów. A – termiczna (R. Huisgen); B katalizowana Cu(I), C promowana naprężeniem cykloalkinu.
Zaletami tej reakcji poza wymienionymi wyżej, jest kompatybilność grup funkcyjnych, odporność tak substratów jak i produktów na wodę, tlen, hydrolizę oraz większość reakcji metabolicznych. Reakcję tę można prowadzić we wodzie lub mieszaninach woda-rozp. organiczny a produkty reakcji w wielu przypadkach oddziela się przez proste sączenie.
Katalityczny wariant cykloaddycji Huisgena znalazał zastosowanie w m. in. chemii medycznej, materiałowej, do modyfikacji produktów naturalnych, immobilizacji i koniugacji cząsteczek oraz w syntezie polimerów (ponad 16 tys. prac od 2001 roku). Z kolei C. Bertozzi zademonstrowała dużą użyteczność cykloalkinów do nieinwazyjnych badań in vivo obejmujących biokoniugację, bioprofilowanie i obrazowanie w biologii molekularnej i medycynie.
Po więcej informacji warto sięgnąć do oryginalnej pracy Sharplessa [1] oraz przejrzeć dedykowany chemii klik tom Science of Synthesis wydany w zeszłym roku [2].
[1] H.C. Kolb, M.G. Finn, K.B. Sharpless, Angew. Chem., 2001, 40, 2005.
[2] Click Chemistry, Rutjes, F. P. J. T., Ed.; Thieme: Stuttgart, 2021;
Prof. UAM dr hab. Karol Kacprzak
Fot. Martyna Płaczek




